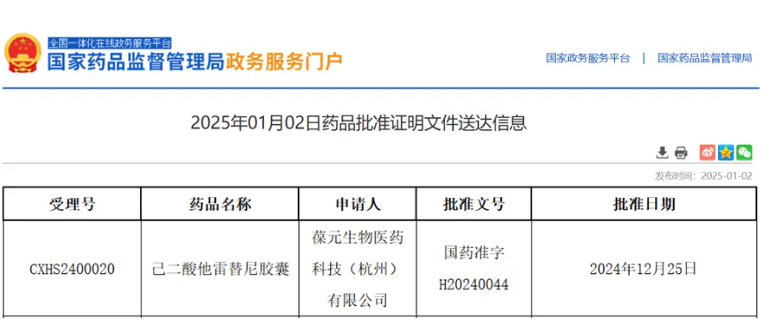
2025年1月2日、中国国家薬品監督管理局(NMPA)の公式サイトで新しい発表がありました。葆元医薬(バオユェン)と信達生物(シンダ・バイオロジクス)が共同開発した次世代ROS1チロシンキナーゼ阻害剤(TKI)「タレクチニブ(他雷替尼)カプセル」の2件目の新薬承認申請(NDA)が承認されました。この薬剤は、未治療の局所進行または転移性ROS1陽性非小細胞肺癌(NSCLC)成人患者に対する第一選択治療として認められました。英放生物(インファン・バイオ)は、国内を代表する画像CRO企業として、本薬剤の第II相臨床試験において包括的な第三者独立画像評価(IRC)サービスを提供しました。
肺がんは世界で最も発症率と死亡率が高い悪性腫瘍の一つであり、その85%は非小細胞肺がん(NSCLC)です。中国では、NSCLC患者の約2.6%がROS1陽性遺伝子を持っていると推定されています。さらに、未治療の転移性ROS1陽性NSCLC患者のうち最大35%が脳に腫瘍が転移していると報告されています。
タレクチニブは経口投与型で、脳への浸透力が強い次世代の選択的ROS1阻害剤です。12月20日にNMPAは、ROS1-TKI治療が失敗した後のROS1陽性局所進行または転移性NSCLC成人患者に対して「条件付き承認」を決定しました。これが中国国内での2件目の適応症承認となります。
今回の承認は、第II相臨床試験TRUST-I(NCT04395677)の良好な結果に基づいています。この試験は、中国の複数の施設が参加した非盲検の単群試験で、ROS1陽性非小細胞肺がん(NSCLC)患者を対象に「ダーボール®」の安全性、耐容性、有効性を評価することを目的としました。TRUST-Iの結果は米国の『臨床腫瘍学雑誌』(JCO)に掲載され、2024年の米国臨床腫瘍学会(ASCO)年次総会で発表されました。未治療群(n=106)では、独立画像評価委員会(IRC)による確認済みの客観的奏効率(cORR)は91%、頭蓋内奏効率(IC-ORR)は88%に達し、中央追跡期間23.5カ月時点でIRC評価の中位奏効持続時間(DoR)および無増悪生存期間(PFS)は未到達でした。
英放生物は2019年から、本剤の承認を支える重要な臨床試験で第三者による独立画像評価を担当してきました。豊富な専門知識、経験豊富な専門家チーム、効率的なプロジェクト管理体制により、高品質な成果を納期通りに提供しています。試験プロトコルに基づき、コンプライアンスを遵守した評価システムを設計し、独自に開発した電子統合管理システムにより評価の効率と精度を大幅に向上させました。また、データベースの完全性を確保し、エンドポイントデータの信頼性を強固にサポートしています。
プロジェクトの開始から中央画像レビューに至るまで、英放生物は関係者と緊密に連携しています。医学画像に関する問い合わせには即座かつ専門的に対応し、厳密なレビュー期限を守るために事前の計画と専門家のスケジュール調整を徹底しています。国家当局の審査が終了した後、葆元医薬は英放チームの専門知識と責任感に対して深い感謝を表明し、サービスの品質が高く評価されました。
英放生物がこれまでに関わった承認プロジェクトは合計32件に上り、そのうち8件は肺がん関連です。さらに、53件の新薬申請をサポートし、そのうち42件が承認されました。この実績により、独立画像評価の専門性と成功を再度示すことができました。
英放生物はパートナー企業の優れた成果を心からお祝いし、今後も高品質なサービスを提供して、革新的な医薬品や医療機器の早期発売を支援し、患者さんの助けになることを期待しています。












 Home
Home Services
Services Telephone
Telephone Message
Message