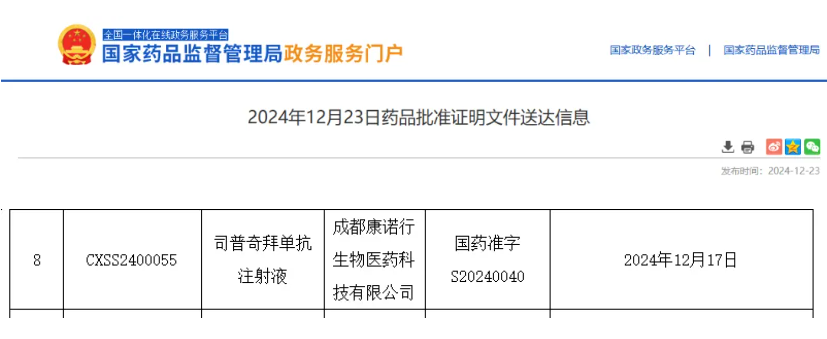
2024年12月23日、中国国家薬品監督管理局(NMPA)の公式サイトで、康諾亜(コンノア)が独自に開発した1類新薬「康悦達®(司普奇バイタンカン注射液)」の市場承認申請が承認されたと発表されました。本薬は慢性副鼻腔炎(鼻ポリープを伴う)の治療を目的としており、この適応症は優先審査対象に指定されていました。国内有数の画像診断CRO企業である英放生物(インファン・バイオ)は、この薬剤の第III相臨床試験で包括的な第三者独立画像評価(IRC)サービスを提供しました。
慢性副鼻腔炎(鼻ポリープを伴う)は、非常に治療が難しい病気であり、鼻詰まり・呼吸困難・嗅覚の低下などの症状が患者の生活の質(QOL)を大きく損ないます。従来の薬物治療や内視鏡を使った鼻内手術では効果が不十分で、持続時間も短く、再発率が高いという問題があり、新しい治療法が求められていました。今回の「司普奇バイタンカン」の適応症承認は、国内の患者に新しい治療の選択肢を提供するものです。
司普奇バイタンカン(CM310)は、IL-4Rαをターゲットにした強力なヒト化抗体であり、II型炎症の主要なサイトカインであるIL-4とIL-13の二重シグナル阻害作用を持ちます。今年9月12日には、成人の中等度から重度のアトピー性皮膚炎治療薬として国内初の承認を受け、中国初、そして世界で2番目のIL-4Rα抗体製剤となりました。
今回の承認は、多施設共同の無作為化二重盲検プラセボ対照第III相試験の結果に基づいています。試験では180人を対象に、1:1の割合で司普奇バイタンカン300mg群とプラセボ群に割り付け、2週間ごとに12回投与しました。24週目の鼻ポリープスコア(NPS)と鼻閉スコア(NCS)のベースラインからの変化を共同一次エンドポイントとしました。試験の結果、共同一次エンドポイントが完全に達成され、プラセボ群に比べて統計的に顕著な有意差(P値すべて<0.0001)が認められました。また、良好な安全性プロファイルも確認されました。

英放生物は2022年から康諾亜と戦略的提携を構築し、このプロジェクトの第III相試験で中心的な画像評価を行いました。多くなエンドポイント評価の経験、高効率のプロジェクトチーム、完備された管理システムを活用し、スポンサーの要件に迅速に対応して製品承認に寄与しました。
本試験では、鼻内視鏡検査と副鼻腔CTを用いた効果評価が行われ、複雑な画像解析と厳格なタイムラインの管理が新たな挑戦となりました。英放チームは関係者と密接に連携し、主要エンドポイントの画像解析を予定より2週間早く、高精度で完了させました。優れたプロジェクト実行力を示しました。
ベースライン評価の厳格な管理が成功の鍵となる中、英放は10ヶ月間で360例以上の被験者スクリーニングを実施しました。研究施設から送られてくる内視鏡データに対して15分以内に品質管理を行い、評価精度の基盤を構築しました。「検査遅延が被験者登録に影響し、再検査を要するリスク」という課題に対して、チームは昼夜を問わない献身的な対応を行い、プロジェクトの進行を確保しました。
データQCを終えた後、画像解析を行い、全被験者のスクリーニング評価を2営業日以内に完了しました。迅速かつ正確な判断プロセスを通じて、短期間で高品質な被験者登録を実現しました。二重盲検期間中もスポンサーと密接に連携し、6ヶ月で約2000タイムポイントの解析を達成しました。スポンサーから高く評価され、今後の協力関係の基盤が築かれました。
特筆すべきは、英放生物が31件の承認取得プロジェクトを達成したことです。国内外の100社以上に対して専門的なIRCサービスを提供し、腫瘍領域に加え、呼吸器、神経、消化器、循環器、皮膚、整形外科、眼科などの幅広い非腫瘍領域に展開しています。300件を超えるプロジェクト実績、53件のNDA申請、42件の審査通過実績は、当社の高品質で高効率なサービスの証です。
英放生物は「品質の追求」を理念に、スポンサーにとって最適な長期パートナーを目指します。今後の医薬品革新の道のりにおいて、皆様との協力によるさらなる成功を心より期待しております。












 Home
Home Services
Services Telephone
Telephone Message
Message