2024年4月24日,国家药品监督管理局(NMPA)官网发布公告,由亿腾景昂开发的I类创新药——恩替司他片(商品名:景助达)新药上市申请正式获批,适应症为联合芳香化酶抑制剂用于治疗激素受体(HR)阳性、人类表皮生长因子受体-2(HER-2)阴性,经内分泌治疗复发或进展的局部晚期或转移性乳腺癌患者。英放生物作为国内领先的影像CRO公司,为该药物的临床Ⅲ期研究提供了全方位第三方独立影像评估IRC服务。
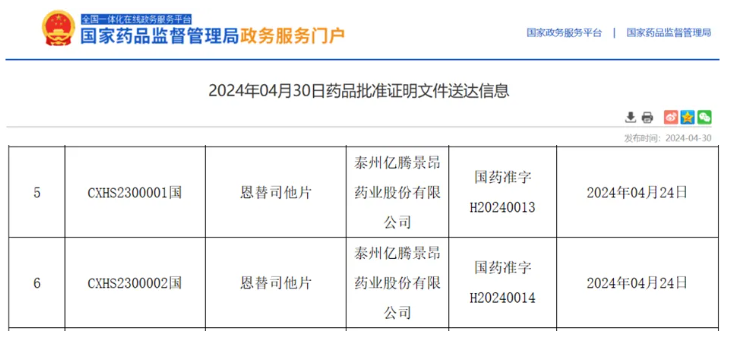
截图来源:NMPA官网
恩替司他是一种新型、口服的HDAC抑制剂,通过选择性抑制I类HDAC,特别是针对有代表性的HDAC 1、2、3亚型,从而调节组蛋白的超乙酰化并促进特定基因的转录活化,最终抑制细胞增殖、加快终末分化和/或诱导凋亡。
2021年7月,在中国开展的恩替司他联合依西美坦治疗激素受体(HR)阳性、人类表皮生长因子受体2(HER-2)阴性晚期乳腺癌患者的随机、双盲、对照Ⅲ期临床研究达到了预设的主要研究终点。结果显示,恩替司他联合依西美坦对比安慰剂联合依西美坦可以显著改善经内分泌治疗失败的HR阳性、HER-2阴性晚期乳腺癌患者的无进展生存期(PFS),差异具有统计学显著性,且安全性数据良好。
研究共入组了354例患者,中位年龄为52岁(范围28~75岁),ECOG 0分和1分的比例分别为53.7%和46.3%。大约31.9%的患者为原发内分泌耐药,38.7%的患者既往曾接受过解救化疗。大多数患者(68.9%)在基线存在内脏转移。组间的基线特征基本均衡。研究结果显示:恩替司他组的PFS较安慰剂组显著延长,疾病进展或死亡的风险降低24%,并且总生存期呈现获益趋势,死亡风险降低16.3%,绝经前或围绝经期患者从恩替司他联合方案的治疗获益与绝经后患者一致。研究的安全性数据与药物已知的安全性特征一致,部分血液学毒性发生率及严重程度低于同类药物。
自2019年伊始,英放生物与亿腾景昂携手,建立了紧密的合作关系。凭借资深的阅片专家团队和高效执行的项目团队,在满足申办方对项目既定的时间节点要求下,提供高效、精准、客观的独立中心影像评估。多年的合作过程中,双方秉持共同信念,配合默契,携手克服了重重挑战,为恩替司他片的成功获批奠定了坚实的基础。
从项目启动至项目顺利关闭的全过程中,英放始终与各方保持着高频次沟通与密切协调。得益于丰富的项目经验和深厚的专业底蕴,英放在方案撰写与讨论中积极参与,并提供即时准确的医学影像咨询服务。不仅涵盖了研究方案的中心影像专业咨询,还有在项目实施过程中影像阅片方面的专业指导与解答。针对试验的特定要求和评估标准,英放为研究中心及阅片人提供系统且全面的培训。在影像质控环节,面对发现的影像质量问题,立即进行反馈,并通过高效沟通迅速解决,确保项目的顺利进行。根据疗效终点评估要求,英放还为该项目设计并建立合法合规的影像评估系统。该系统基于英放自主研发的先进技术,实现全流程电子化和一体化管理,极大地提高了阅片的质量和效率,同时也保证了研究数据的完整性和可追溯性。在应对国家局核查时,英放团队与申办方紧密协作,针对核查老师的疑问和要求,给予了详尽且准确的回复解答。整个过程中,英放的专业度和敬业度赢得了申办方的高度赞誉和一致好评。
值得一提的是,随着恩替司他片的上市,英放助力获批的项目已达27个。自成立以来,英放生物深耕独立影像评估领域多年,拥有一支稳定的高素质团队,始终以客户为中心,提供专业化服务,立志成为申办方最值得信赖的长期合作伙伴。至今已为国内外上百家企业提供了专业的IRC服务,执行临床试验注册项目数量超过280个,近40个项目已成功递交至NMPA。
英放生物期待携手更多全球医疗健康行业客户,助力创新医药研发,造福更多患者!












 首页
首页 影像服务
影像服务 电话咨询
电话咨询 留言
留言